Por Juan Pablo Atal
Universidad de Pensilvania
José Ignacio Cuesta
PhD (c) Universidad de Chicago
En el mercado farmacéutico nacional conviven medicamentos innovadores con medicamentos genéricos sin marca y medicamentos genéricos con marca. Los medicamentos genéricos sin marca son copias del innovador original denominadas en base a su principio activo, mientras que los genéricos con marca también son copias del innovador original pero son comercializados con un nombre de fantasía. En el año 2010, los medicamentos genéricos sin marca constituían menos del 30 por ciento de las ventas en farmacias en el mercado chileno, aún cuando su precio era en promedio 6 veces menor que el precio de genéricos con marca y 10 veces menor que el precio de los medicamentos innovadores, tal como se puede apreciar en la siguiente Figura. Teniendo en consideración estas cifras, la sustitución hacia medicamentos genéricos –en particular hacia genéricos sin marca– parecería ser una estrategia directa para disminuir el gasto de bolsillo en salud de los chilenos. En efecto, el aumento en el uso de medicamentos genéricos ha sido una de las mayores fuentes de ahorro en gastos en salud en Estados Unidos en las últimas décadas.
Precio relativo de medicamentos innovadores y genéricos con marca respecto de medicamentos genéricos sin marca, Chile, 2010
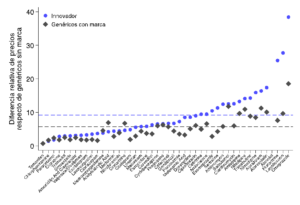
Fuente: Cálculos propios en base a IMS Health. Las líneas punteadas horizontales indican el promedio del precio relativo a través de las moléculas consideradas, para medicamentos referente y genéricos con marca respectivamente. La muestra incluye moléculas para las cuáles existen medicamentos innovadores, genéricos de marca y génericos sin marca.
Los mercados farmacéuticos se caracterizan por la existencia de diversas fallas de mercado que disminuyen la posibilidad de que la sustitución de medicamentos de marca por medicamentos genéricos se produzca de forma natural, aún cuando sea deseable desde el punto de vista social. Por ejemplo, la existencia de potenciales asimetrías de información entre el productor y el consumidor respecto de la calidad de los medicamentos limita la posibilidad de que los genéricos se posicionen como una alternativa efectiva y generen mayor competencia en el mercado. En este contexto de asimetrías de información se justifica la existencia de un ente regulador que certifique, mediante estándares técnicos, que todos los medicamentos genéricos comercializados sean un sustituto de alta calidad. Esto no solo previene que medicamentos dañinos o poco efectivos entren al mercado, sino que además aumenta la confianza de pacientes y médicos en los genéricos.
En base a ese diagnóstico, Chile ha avanzado hacia exigir mayores estándares de calidad para los medicamentos genéricos en los últimos años, mediante la implementación de una política de bioequivalencia. La bioequivalencia es el estándar de calidad exigido a los medicamentos genéricos más común en los países desarrollados, y es la base de las políticas de aseguramiento de calidad recomendadas para los países en desarrollo.
Un medicamento es bioequivalente al medicamento establecido como referencia (que, salvo en contadas excepciones, corresponde al innovador) si es que la cantidad absorbida y la velocidad de absorción del principio activo no difieren de forma significativa entre ambos. El medicamento innovador puede sustituirse por un medicamento bioequivalente con la expectativa de que el sustituto produzca el mismo efecto terapéutico. Así, un consumidor debería esperar los mismos efectos terapéuticos de un genérico bioequivalente (con o sin marca) que del medicamento innovador.
En Chile, bajo la supervisión del Instituto de Salud Pública (ISP), los requerimientos de bioequivalencia se han ido implementado de forma paulatina desde el 2009 para una lista de 167 moléculas. Todos los medicamentos nuevos que contienen tales moléculas deben mostrar pruebas que certifiquen su bioequivalencia para poder obtener un registro sanitario del ISP y, así, ser aptos para la comercialización. Esta medida aplica en la práctica para los medicamentos en presentación sólida y de administración oral. Asimismo, la ley estableció plazos para que los medicamentos con registro sanitario vigente presentasen los estudios de bioequivalencia correspondientes. Desde entonces los laboratorios han comenzado a certificar la bioequivalencia de sus medicamentos al momento de obtener o renovar sus registros de comercialización por parte del ISP, tendencia que se muestra en la figura siguiente.
Certificaciones de bioequivalencia a través del tiempo
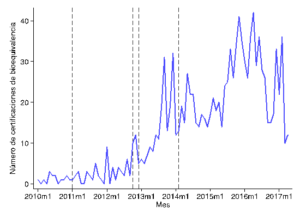
Fuente: Cálculos propios en base a datos del ISP. Las líneas punteadas verticales indican distintos decretos de bioequivalencia.
Para obtener tal certificación, los fabricantes deben recurrir a laboratorios especializados en ese tipo de certificaciones, lo que impone un costo adicional para llevar sus medicamentos al mercado. Este costo se ha estimado en torno a los $50MM.
¿Qué se puede esperar de una política de regulación de calidad en el mercado farmacéutico?
El objetivo de las políticas de regulación de calidad como la bioequivalencia es asegurar la calidad de los medicamentos, generar un cambio en la percepción de la calidad de los medicamentos genéricos en la población y, por consiguiente, aumentar la sustitución del producto y la competencia en precios. En efecto, en las etapas iniciales de su implementación, El diario La Tercera (2012) reportó que las autoridades estimaban que la exigencia de bioequivalencia podía llegar a reducir el costo de la canasta familiar de medicamentos en un 30 por ciento.
El efecto total en el gasto en medicamentos de una política de bioequivalencia tiene diversas componentes. Por una parte, se espera sustitución de medicamentos de marca por medicamentos genéricos bioequivalentes y reducciones de precios como consecuencia de los mecanismos destacados anteriormente.
Sin embargo, la exigencia de bioequivalencia puede tener efectos contraproducentes pues ésta impone costos fijos de entrada adicionales y costos para permanecer en el mercado. Esta situación puede reducir la entrada o inducir la salida de medicamentos genéricos del mercado si es que participar en éste deja de ser rentable bajo las nuevas condiciones. Mas aún, tal cambio en la estructura de mercado podría tener efectos adversos sobre la competencia en precios y reducir aún más los potenciales beneficios de la bioequivalencia en términos de acceso a medicamentos a menores precios.
La literatura económica ha estudiado las potenciales consecuencias teóricas de introducir estándares mínimos de calidad como el de la bioequivalencia, formalizando las intuiciones expuestas anteriormente. En términos generales, los efectos teóricos de la bioequivalencia en el mercado y el bienestar de los consumidores pueden describirse como una combinación de efectos de valoración y efectos de composición. Los efectos de valoración surgen cuando los consumidores cambian su percepción de la calidad de los genéricos como consecuencia de la bioequivalencia. Por su parte, los efectos de composición son los relativos al cambio en la estructura de mercado inducido por la regulación.
El efecto total de la política de bioequivalencia depende de la magnitud relativa de los efectos de composición. En la práctica, la magnitud de ambos efectos depende de variables fundamentales que pueden afectar crucialmente el éxito de la política.
Efectos de valoración.
 La existencia de asimetrías de información hace que la regulación de calidad cambie la demanda por medicamentos genéricos. En particular los efectos de valoración se refieren al aumento de la demanda por medicamentos genéricos que obtienen certificación de bioequivalencia en desmedro de los medicamentos innovadores. Esto, debido a que los consumidores internalizan que la calidad de medicamentos que obtienen la certificación es mayor o igual al estándar impuesto por la norma. Asimismo se espera una disminución en las diferencias de calidad percibida entre los genéricos de marca y los genéricos sin marca. Esta disminución en diferenciación vertical aumenta la competencia en precios. Como consecuencia, se esperaría que el precio de los innovadores disminuyera. Sin embargo, el efecto sobre los medicamentos genéricos es ambiguo. En este caso, se contrapone el alza en la demanda –fruto de la mayor calidad percibida por los consumidores– con una competencia en precios más intensa.
La existencia de asimetrías de información hace que la regulación de calidad cambie la demanda por medicamentos genéricos. En particular los efectos de valoración se refieren al aumento de la demanda por medicamentos genéricos que obtienen certificación de bioequivalencia en desmedro de los medicamentos innovadores. Esto, debido a que los consumidores internalizan que la calidad de medicamentos que obtienen la certificación es mayor o igual al estándar impuesto por la norma. Asimismo se espera una disminución en las diferencias de calidad percibida entre los genéricos de marca y los genéricos sin marca. Esta disminución en diferenciación vertical aumenta la competencia en precios. Como consecuencia, se esperaría que el precio de los innovadores disminuyera. Sin embargo, el efecto sobre los medicamentos genéricos es ambiguo. En este caso, se contrapone el alza en la demanda –fruto de la mayor calidad percibida por los consumidores– con una competencia en precios más intensa.
En la práctica, la magnitud de los efectos de valoración dependerá (i) de cuán exitosa sea la política de bioequivalencia en cambiar las percepciones respecto de la calidad de los genéricos y (ii) de hasta qué punto los consumidores seguirán siendo leales a los medicamentos innovadores aún tras la disminución de la diferencia respecto de la calidad percibida. De hecho, incluso en países con políticas de bioequivalencia de larga data como es el caso de Estados Unidos, los consumidores tienden a preferir el medicamento innovador. Además, se ha demostrado que consumidores con poca experiencia en el uso de medicamentos genéricos pueden tener sesgos persistentes en contra del uso de éstos, dificultando particularmente el éxito de las políticas de bioequivalencia en el corto plazo. En este contexto, políticas complementarias de información sobre calidad de los genéricos podrían entonces aumentar la efectividad de políticas de regulación de calidad.
Por otra parte, la reacción de los consumidores no puede entenderse de forma independiente del comportamiento de los médicos. En particular en lo que respecta a medicamentos con receta que constituyen la gran mayoría de los medicamentos afectos a la regulación. Por diversas razones, los médicos pueden enfrentar incentivos distintos a los de sus pacientes y limitar los efectos de la política que incentiva la bioequivalencia . La Ley de Fármacos del año 2014 introdujo cambios en la dirección correcta en este aspecto, al exigirles a los médicos que incluyeran el nombre del principio activo en la receta médica, a fin de facilitar la sustitución. Lamentablemente, aún no existen datos respecto del nivel de cumplimiento de esta normativa, aunque la evidencia anecdótica que hemos recabado indica que el cumplimiento ha sido limitado.
Efectos de composición
La bioequivalencia puede inducir cambios en la estructura de mercado. La fuente principal de tales cambios es el hecho de que los laboratorios se ven obligados a elegir entre certificar bioequivalencia o no obtener el permiso para comercializar el producto y, por ende, no entrar o bien salir del mercado.
Cuando los costos de certificación son demasiado altos, algunos laboratorios pueden optar por dejar de comercializar sus productos. Tales decisiones dependen tanto de los atributos del medicamento como de las características del mercado en que operarían.
Por ejemplo, se podría esperar que en mercados de altas ventas los efectos de composición sean menores que en mercados pequeños, dado que en estos últimos los costos de certificación de bioequivalencia son mayores relativo al tamaño del mercado. Este efecto podría ser relevante para productos genéricos sin marca, dado que estos usualmente cuentan con una baja calidad percibida por los consumidores y, por tanto, con menores márgenes. Tal es el caso también para principios activos con un bajo número de consumidores, siendo éstos los potencialmente más afectados por los costos de certificación. Por supuesto, políticas que reduzcan los costos de certificación podrían ser efectivas en términos de limitar efectos de composición.
Si bien la salida de medicamentos genéricos disminuye la competencia en el mercado, los efectos en los precios son ambiguos. De hecho, la salida de medicamentos genéricos puede inducir al innovador a disminuir sus precios con el objeto de aumentar sus ventas entre los consumidores con mayor elasticidad-precio que, previo a la regulación, consumían el medicamento genérico. Este efecto es conocido como la «paradoja de los genéricos» y fue documentada tras el aumento de precio de los medicamentos innovadores luego de la entrada de medicamentos genéricos tras la expiración de patentes posterior al acta de Hatch y Waxman.
Evidencia preliminar
Un estudio previo de Balmaceda, Espinoza y Díaz analizó los efectos en el precio de la bioequivalencia en las primeras etapas de su implementación. Sus resultados apuntan a la existencia de abundante heterogeneidad en la dirección y magnitud de tales efectos, sin un patrón claro. En nuestro estudio en progreso, “Quality Regulation and Competition: Evidence from Pharmaceutical Markets” (2018, Manuscrito, CAF), desarrollado conjuntamente con Morten Sæthre, examinamos los efectos de la política de bioequivalencia sobre el mercado farmacéutico chileno tanto en precios como en la estructura de mercado. Abajo se destacan algunas tendencias relevantes.
Por una parte, combinando datos de ventas de IMS Health con datos sobre certificación de bioequivalencia de ISP, es posible cuantificar la evolución de la participación de mercado de productos de distinto tipo, expuestos en la figura siguiente. Dos patrones relevantes saltan a la vista. El primero es que existe una tendencia general hacia un aumento en la participación de mercado de productos genéricos respecto del innovador. El segundo es que los genéricos bioequivalentes han ganado terreno a medida que el proceso de certificación se ha llevado a cabo. Sin embargo, no pareciera que durante este período los genéricos sin marca hayan ganado terreno relativo a los genéricos de marca.
Participación de mercado por tipo de producto
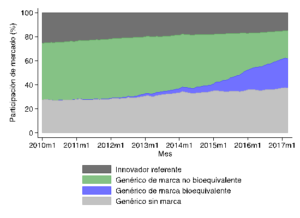
Fuente: Cálculos propios en base a IMS Health.
Adicionalmente, los datos del registro sanitario del ISP nos permitieron estudiar los patrones de entrada y salida del mercado en torno a la implementación de la política de bioequivalencia. Las Figuras (a) y (b) muestran la evolución de la entrada y salida de productos del registro de ISP en torno a dos fechas relevantes de la política: la fecha de promulgación del primer decreto que afecta a los principios activos involucrados, y el plazo final establecido para que los productos que los contengan presenten la certificación correspondiente.
Si bien estas figuras no permiten un análisis de impacto riguroso, sí sugieren que la salida de productos es mayor después de estas fechas. Esto indica que la certificación ha inducido la salida de productos del mercado, que se explicaría por dos razones. En primer lugar, es posible que esos productos efectivamente no hayan sido bioequivalentes y, por lo tanto, los laboratorios decidieran directamente no intentar certificar tal condición. Por otra parte, es posible que los laboratorios decidieran salir del mercado debido al alto costo de certificación relativo al beneficio de participar en el mercado. Si bien ambas razones tienen implicancias distintas, ambas causan efectos adversos sobre la competencia en precios mediante los efectos en composición discutidos más arriba.
Entrada y salida de medicamentos en torno al decreto y al plazo límite estableciendo requerimientos de bioequivalencia
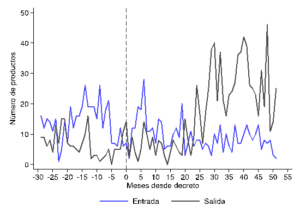
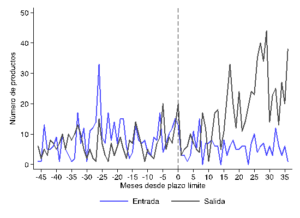
(a) Decreto (b) Plazo límite
Fuente: Cálculos propios en base a datos del ISP.
Finalmente, se puede analizar la evolución de precios relativos de distintos medicamentos, comparando las diferencias de precios en el año 2010 con las diferencias de precios promedio post 2016. La primera comparación muestra que la diferencia de precios entre medicamentos innovadores y medicamentos genéricos se ha mantenido estable en el período, tal como se presenta en la figura siguiente. Aun cuando se aprecian reducciones importantes de este diferencial en algunos principios activos (como por ejemplo la Levofloxacina, en cuyo caso el diferencial entre el referente y el genérico sin marca se redujo de casi 30 a menos de 10), en promedio las diferencias se han mantenido estables en torno a 10 veces. Una conclusión similar se desprende del análisis de los diferenciales entre medicamentos genéricos de marca y medicamentos genéricos sin marca, como muestra la figura siguiente.
Precio relativo de medicamentos innovadores y genéricos con marca respecto de medicamentos genéricos sin marca, 2010 vs 2016

(a) Medicamentos innovadores
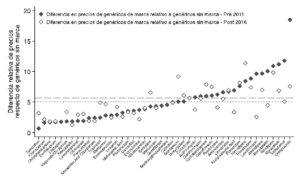
(b) Medicamentos genéricos de marca
Fuente: Cálculos propios en base a IMS Health. Las líneas sólidas y punteadas horizontales indican el promedio del precio relativo a través de las moléculas consideradas para 2010 y 2016 respectivamente. La muestra incluye moléculas para las cuáles existen medicamentos innovadores, genéricos de marca y génericos sin marca.
Discusión
Los mercados farmacéuticos son complejos debido a que combinan diversas relaciones entre laboratorios, médicos y farmacias. Asimismo, la información es difusa para los consumidores. Por otra parte, son mercados que proveen un producto de primer orden de relevancia para el bienestar de la población. Por lo tanto, es importante combinar un diseño cuidadoso de políticas públicas en el mercado con investigación que mida sus impactos.
En el caso de la política de bioequivalencia, se han expuesto mecanismos conceptuales que podrían contrarrestar los efectos positivos esperados por la autoridad. ¿Cuál de estos efectos domina? Es una pregunta empírica cuya respuesta depende de las características propias de los mercados. Nuestra investigación pretende dar luces para el futuro diseño de políticas de regulación de calidad para el mercado farmacéutico.
Cabe destacar que la regulación de calidad a través de distintos países muestra que las políticas de bioequivalencia son en general acompañadas por otros instrumentos. En la práctica, las regulaciones de bioequivalencia se han entendido como una condición necesaria para la implementación de las estrategias de política más agresivas utilizadas en otros contextos, como por ejemplo la sustitución obligatoria hacia genéricos o las regulaciones explícitas de los precios a través de la cobertura pública (OMS, 2000).
En el caso de Chile, en el Congreso se discute la Ley de Fármacos II que, entre otras cosas, considera que la receta se haga exclusivamente por principio activo (Denominación Común Internacional). Dadas las asimetrías de información en el mercado, una política de regulación de calidad de genéricos como la bioequivalencia es ciertamente deseable antes de avanzar en esa dirección. Así, la bioequivalencia se puede entender como un primer paso necesario, aunque posiblemente insuficiente, para lograr disminuir el gasto en medicamentos en Chile sin poner en riesgo la salud de la población.